Background.
Cellular resistance is an increasing problem in the treatment of haematological malignancies and solid tumours with cytotoxic nucleoside analogues. Studies on cellular models and clinical samples have allowed insight into the mechanisms behind this resistance.
Material and methods.
An overview of cytotoxic nucleoside analogues, their metabolism and their mechanism of action is presented. Studies on resistance to nucleoside analogues are reviewed. Results were collected from the literature in the PubMed database and from research in our laboratory.
Results and interpretation.
Variations in the activity of nucleoside transporters and proteins of the intracellular metabolism are implicated in the result of treatment with nucleoside analogues. These proteins are kinases, 5’-nucleotidases and deaminases. Mechanisms identified in cell models or in samples from non-responding patients should be validated in treated patients. These mechanisms are prognostic factors for the clinical outcome in nucleoside analogue-treated patients.
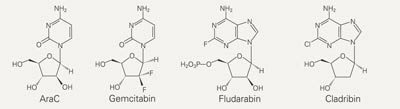
Nukleosidanaloger brukes til behandling av maligne blodsykdommer og noen krefttyper (1). Blant disse cytotoksiske molekylene finner man pyrimidinanalogene cytarabin og gemcitabin samt purinanalogene fludarabin og cladribin (fig 1). Cytarabin, eller 1-β-D-arabinofuranosylcytosin (araC), er en essensiell del av behandlingen av akutt myelogen leukemi der den brukes alene eller i kombinasjon med antrasykliner. Den eneste strukturelle forskjellen fra cytidin er arabinosen som erstatter ribosen. Gemcitabin, eller difluorodeoksycytidin, er den eneste nukleosidanalog som er aktiv på ikke-hematologiske kreftlokalisasjoner som pancreas, lunge og blære. Flere kreftlokalisasjoner studeres for tiden, som for eksempel brystkreft og visse maligne blodsykdommer. Strukturen til gemcitabin har to fluoratomer på 2’-posisjonen av sukkerdelen av molekylet. Fludarabin, eller 9-β-D-arabinosyl-2-fluoroadenin, brukes til behandling av kronisk lymfatisk B-celle leukemi og er også aktiv på lavgradig non-Hodgkins lymfom og andre lymfomtyper. På grunn av dårlig hydrofil løselighet, administreres fludarabin som den monofosforylerte formen. Cladribin, eller 2-kloro-2’-deoksyadenosin, er en annen adeninanalog som brukes til behandling av hårcelleleukemi.
Metabolisme og virkemåte
Nukleosidanalogene er antimetabolitter, og aktiviteten deres bygger på metabolismen til fysiologiske nukleosider (fig 2) (2). Nukleosidanalogene transporteres inn i cellene av de spesifikke nukleosidtransportørene ENT (equilibrative nucleoside transporter) og CNT (concentrative nucleoside transporter) (3). Inne i cellen er nukleosidanalogene fosforylert av nukleosidkinaser (4). Deoksycytidinkinase er det viktigste enzymet i denne aktiveringen og kan fosforylere alle de fire nukleosidanalogene beskrevet over. Den første fosforyleringsetappen er den begrensende etappen i den intracellulære aktiveringen av nukleosidanalogene. Monofosforylerte nukleosidanaloger blir videre fosforylert av andre kinaser til di- og trifosforylerte metabolitter, som er de cytostatisk aktive metabolittene til nukleosidanalogene.
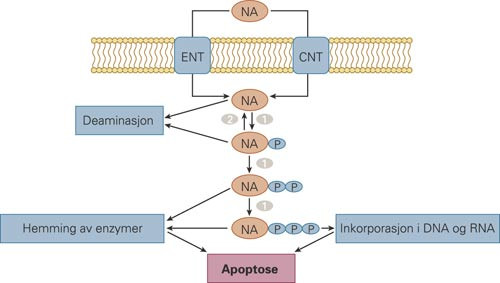
Trifosfater er gode hemmere av DNA-syntesen både ved inkorporering i nukleinsyren og ved direkte blokkering av polymerasene. Konsentrasjonen av fysiologiske nukleosider og deoksynukleosider er avgjørende for aktiviteten til nukleosidanalogene, siden det er direkte konkurranse mellom disse molekylene for inkorporasjon i DNA. Skadene påført DNA fører til reduksjon i celledeling og induksjon av apoptose.
Andre mekanismer som er med på induksjonen av apoptose er redusert RNA-syntese og hemming av enzymer som CTP-syntetase og ribonukleotidreduktase. Ribonukleotidreduktase er enzymet som reduserer ribonukleosiddifosfater til deoksyribonukleosidtrifosfater og er derfor et viktig element i DNA-syntesen. Hemming av dette enzymet fører derfor til mindre deoksyribonukleosidtrifosfater i cellen, og den DNA-hemmende effekten til nukleosidanaloger er dermed forsterket.
Det finnes også intracellulære mekanismer som motarbeider aktiviseringen av nukleosidanalogene. Først og fremst kan nukleosidtransportørene ENT transportere molekylene ut av cellene. Cytidinanalogene araC og gemcitabin kan også omdannes av cytidindeaminase til inaktive metabolitter. Monofosforylerte nukleosidanaloger kan også bli defosforylert av 5’-nukleotidaser (5). Disse er spesifikke fosforylaser som inngår i reguleringssykler som bestemmer de intracellulære konsentrasjonene av fysiologiske nukleosider. Når det gjelder direkte defosforylering av nukleosidanaloger, er det påvist at de cytoplasmatiske 5’-nukleosidasene cN-II og cN-III kan defosforylere henholdsvis monofosforylert fludarabin (L.P. Jordheim, upubliserte data) og monofosforylert araC (6). En større studie med 5’-nukleosidasene cdN, mdN og cN-II kunne bare påvise svak aktivitet for disse proteinene med diverse nukleosidanaloger som substrat (7).
I tillegg til 5’-nukleosidaser og deaminaser vil DNA-reparerende proteiner minke aktiviteten til nukleosidanaloger ved å ta vekk inkorporerte nukleosidanaloger fra DNA. Proteinet TP53 som inngår i apoptose-induksjonen i nukleosidanalogbehandlede celler, har en 3’-5’-eksonukleaseaktivitet som virker på nukleosidanaloger (8). Andre DNA-reparerende mekanismer som virker på nukleosidanaloger, er også påvist.
Resistensmekanismer
Skjemaet over nukleosidanalogenes metabolisme og virkemåte viser de etappene hvor forandringer kan variere cellenes sensibilitet overfor disse molekylene (fig 2). Disse forandringene kan gjøre cellene resistente, og de forskjellige resistensmekanismene kan deles inn i tre kategorier (2).
Den første kategorien inneholder alle forandringer i proteiner som inngår i de etappene av metabolismen som jobber for en intracellulær oppsamling av den aktive metabolitten. I denne gruppen finner vi derfor kvalitative og kvantitative forandringer av nukleosidtransportører og kinaser, men også 5’-nukleotidaser og deaminaser. I den andre gruppen samles endringer i de proteinene som nukleosidanalogene inngår direkte i kontakt med, som DNA-polymeraser, ribonukleotidreduktase og CTP-syntetase. I den tredje kategorien finner vi forandringene cellene kan gjennomgå for å forandre deres reaksjon på det stresset som nukleosidanalogene har påført dem. Denne resistenstypen kan komme av forandringer i mekanismen som gjenkjenner DNA-innlemmet nukleosidanaloger, i reparasjonsmekanismene eller i proteinene som inngår i apoptosen.
Resistensmekanismene til de forskjellige nukleosidanalogene varierer, og de er blitt studert ved hjelp av resistente cellemodeller, men også ved prøver fra pasienter som er behandlet med disse medikamentene.
Cellestudier
Mange studier har vært utført for å identifisere cellulære forandringer som kan forklare resistensen til nukleosidanaloger. En mye brukt modell er kreftcellelinjer som er blitt resistente ved å bli utsatt for behandling med nukleosidanaloger over lengre tid. Denne type modeller kan gjenspeile det som skjer hos pasienter som behandles og som utvikler resistente kreftceller ved tilpassing.
De fleste av de modellene som er blitt utarbeidet ved å utsette kreftcellelinjer for økende konsentrasjoner av nukleosidanaloger over en lengre periode, blir resistente på grunn av tap av deoksycytidinkinase. Dette har vært observert i celler fra menneske og mus med alle de cytotoksiske nukleosidanalogene (9) – (13). Tapet av deoksycytidinkinase kan forklares blant annet ved tap av deler av genet (10, 11). Andre forandringer som er blitt identifisert i disse resistente cellelinjene, er tap av nukleosidtransportører (9), økning av 5’-nukleotidasen cN-II (14) og økning i ribonukleotidreduktase (15). Vi har nylig utviklet en gemcitabinresistent brystkreftmodell hvor vi har kunnet påvise en sterk økning i ribonukleotidreduktase (L.P. Jordheim, upubliserte data). Dette enzymet ser derfor ut til å spille en stor rolle i aktiviteten til gemcitabin. Alle disse forandringene i proteiner som inngår i nukleosidanalogenes metabolisme og virkemåte kan forklare den resistensen som er påført disse cellene. Siden disse studiene aldri er komplette, kan man allikevel ikke se bort ifra at disse cellene også har andre forandringer som kan være med på å gjøre dem resistente.
Noen av resistensmekanismene som er blitt identifisert i disse cellene, er blitt bekreftet ved hjelp av transfeksjonsstudier med de forskjellige genene. Derfor vet man nå for eksempel at gemcitabin er transportert av nukleosidtransportøren hCNT1 (16) og at alle de fire cytotoksiske nukleosidanalogene er fosforylert av deoksycytidinkinase (17). Inaktivering av araC og gemcitabin av cytidindeaminase (18) samt rollen til ribonukleotidreduktase i den cytotoksiske aktiviteten til gemcitabin (19) er også blitt påvist på denne måten.
Kliniske studier
Flere studier av resistens mot nukleosidanaloger utført på prøver fra pasienter, særlig med leukemi, har vist den kliniske relevansen av de ovenfornevnte cellulære mekanismene.
Transkripsjons- og ekspresjonsnivået til nukleosidtransportøren hENT1 er vist å ha betydning for den cytotoksiske aktiviteten til araC og fludarabin ved leukemi (20) og for respons på gemcitabin ved pancreascancer (21). Tilsvarende er nylig blitt påvist for de to andre transportørene hENT2 (22) og hCNT3 (23) hos leukemipasienter.
Resistens ved tap av deoksycytidinkinase har vist seg å være klinisk relevant (24). Pasienter med lavt mRNA-nivå for denne kinasen ved diagnostikk har en kortere levetid enn de med høyt nivå, og de som får tilbakefall etter en araC-behandling har et lavere nivå når tilbakefallet kommer enn ved diagnosetidspunktet (25). Hvordan denne kinasen er nedregulert hos visse pasienter, er uklart. Noen mutasjoner i deoksycytidinkinasegenet er blitt påvist, men hvor relevante disse er i den kliniske resistensen til araC er ennå ikke helt klarlagt.
Videre er det funnet at pasienter som har et høyt transkripsjonsnivå av cytidindeaminase har dårlig behandlingsrespons (26). I vårt laboratorium har vi kunnet påvise at 5’-nukleotidasene inngår i utfallet av en behandling av leukemi med nukleosidanaloger. Et høyt transkripsjonsnivå med cN-II samsvarer med en dårligere respons på behandling med araC av akutt myelogen leukemi (27). Dette resultatet viser at cN-II er med på å bestemme aktiviteten til araC selv om det ikke kan defosforylere monofosforylert araC. For en annen 5’-nukleotidase, cdN, korrelerer et lavt transkripsjonsnivå med dårlig behandlingseffekt (28). En nylig publisert studie har vist en korrelasjon mellom mRNA-nivået til det ene proteinet av ribonukleotidreduktase (R1) og gjennomsnittlig overlevelse av gemcitabinbehandlede pasienter med lungekreft (29).
Konklusjon
Den gode kjennskapen til genene og proteinene som inngår i nukleosidanalogenes metabolisme og virkemåte, har gjort undersøkelsen av resistensmekanismene til disse molekylene lettere. Det har dermed vært mulig å identifisere de proteinene som transporterer, fosforylerer, defosforylerer og deaminerer de forskjellige nukleosidanalogene. I tillegg er rollene til disse proteinene i resistensen til nukleosidanalogene blitt påvist, både i cellemodeller og hos behandlede pasienter. Strukturelle studier av proteinene vil gi informasjon som vil være nyttig i utviklingen av nye molekyler. Kunnskap om nukleosidanalogresistens i kreftceller har vært grunnlaget for utviklingen av metoder for å gjennvinne cytotoksisk aktivitet på resistente modeller (11, 30). Sannsynligvis vil en fordypet innsikt i de forskjellige mekanismene være med på å forbedre behandlingen av resistente krefttyper.
Studiet av cellenes reaksjoner etter en behandling med nukleosidanaloger bør fortsette for å øke kunnskapen om forskjellene mellom aktiviteten til disse molekylene og mellom pasienter. De intracellulære aktiveringsetappene er godt kjent, mens mekanismen til apoptosen som er det siste ledd i aktiviteten til de cytotoksiske nukleosidanalogene, forsatt er ukjent. Nye studier av denne apoptosen og DNA-reparasjon vil fylle ut kjennskapen til virkemåten for cytotoksiske nukleosidanaloger.
Manuskriptet ble godkjent 9.2. 2005.
Oppgitte interessekonflikter: Ingen
Resistens mot cytotoksiske nukleosidanaloger begrenser bruken deres
Resistensmekanismer er blitt identifisert ved in vitro- og in vivo-studier
Kjennskap til resistensmekanismene vil kunne forbedre behandlingen med cytotoksiske nukleosidanaloger
- 1.
Galmarini CM, Mackey JR, Dumontet C. Nucleoside analogues and nucleobases in cancer treatment. Lancet Oncol 2002; 3: 415 – 24.
- 2.
Jordheim L, Galmarini CM, Dumontet C. Drug resistance to cytotoxic nucleoside analogues. Curr Drug Targets 2003; 4: 443 – 60.
- 3.
Mackey J, Baldwin SA, Young JD et al. Nucleoside transport and its significance for anticancer drug resistance. Drug Resist Updat 1998; 1: 310 – 24.
- 4.
Eriksson S, Munch-Petersen B, Johansson K et al. Structure and function of cellular deoxyribonucleoside kinases. Cell Mol Life Sci 2002; 59: 1327 – 46.
- 5.
Bianchi V, Spychala J. Mammalian 5"-nucleotidases. J Biol Chem 2003; 278: 46195 – 8.
- 6.
Amici A, Emanuelli M, Magni G et al. Pyrimidine nucleotidases from human erythrocyte possess phosphotransferase activities specific for pyrimidine nucleotides. FEBS Lett 1997; 419: 263 – 7.
- 7.
Mazzon C, Rampazzo C, Scaini MC et al. Cytosolic and mitochondrial deoxyribonucleotidases: activity with substrate analogs, inhibitors and implications for therapy. Biochem Pharmacol 2003; 66: 471 – 9.
- 8.
Feng L, Achanta G, Pelicano H et al. Role of p53 in cellular response to anticancer nucleoside analog-induced DNA damage. Int J Mol Med 2000; 5: 597 – 604.
- 9.
Gourdeau H, Clarke ML, Ouellet F et al. Mechanisms of uptake and resistance to troxacitabine, a novel deoxycytidine nucleoside analogue, in human leukemic and solid tumor cell lines. Cancer Res 2001; 61: 7217 – 24.
- 10.
Galmarini CM, Clarke ML, Jordheim L et al. Resistance to gemcitabine in a human follicular lymphoma cell line is due to partial deletion of the deoxycytidine kinase gene. BMC Pharmacol 2004; 4: 8.
- 11.
Jordheim LP, Cros E, Gouy MH et al. Characterization of a gemcitabine-resistant murine leukemic cell line: reversion of in vitro resistance by a mononucleotide prodrug. Clin Cancer Res 2004; 10: 5614 – 21.
- 12.
Chandra J, Mansson E, Gogvadze V et al. Resistance of leukemic cells to 2-chlorodeoxyadenosine is due to a lack of calcium-dependent cytochrome c release. Blood 2002; 99: 655 – 63.
- 13.
Mansson E, Spasokoukotskaja T, Sallstrom J et al. Molecular and biochemical mechanisms of fludarabine and cladribine resistance in a human promyelocytic cell line. Cancer Res 1999; 59: 5956 – 63.
- 14.
Schirmer M, Stegmann AP, Geisen F et al. Lack of cross-resistance with gemcitabine and cytarabine in cladribine-resistant HL60 cells with elevated 5"-nucleotidase activity. Exp Hematol 1998; 26: 1223 – 8.
- 15.
Davidson JD, Ma L, Flagella M et al. An increase in the expression of ribonucleotide reductase large subunit 1 is associated with gemcitabine resistance in non-small cell lung cancer cell lines. Cancer Res 2004; 64: 3761 – 6.
- 16.
Garcia-Manteiga J, Molina-Arcas M, Casado FJ et al. Nucleoside transporter profiles in human pancreatic cancer cells: role of hCNT1 in 2",2"-difluorodeoxycytidine- induced cytotoxicity. Clin Cancer Res 2003; 9: 5000 – 8.
- 17.
Hapke DM, Stegmann AP, Mitchell BS. Retroviral transfer of deoxycytidine kinase into tumor cell lines enhances nucleoside toxicity. Cancer Res 1996; 56: 2343 – 7.
- 18.
Boivin AJ, Gourdeau H, Momparler RL. Action of troxacitabine on cells transduced with human cytidine deaminase cDNA. Cancer Invest 2004; 22: 25 – 9.
- 19.
Duxbury MS, Ito H, Benoit E et al. Retrovirally mediated RNA interference targeting the M2 subunit of ribonucleotide reductase: A novel therapeutic strategy in pancreatic cancer. Surgery 2004; 136: 261 – 9.
- 20.
Galmarini CM, Thomas X, Calvo F et al. Potential mechanisms of resistance to cytarabine in AML patients. Leuk Res 2002; 26: 621 – 9.
- 21.
Spratlin J, Sangha R, Glubrecht D et al. The absence of human equilibrative nucleoside transporter 1 is associated with reduced survival in patients with gemcitabine-treated pancreas adenocarcinoma. Clin Cancer Res 2004; 10: 6956 – 61.
- 22.
Molina-Arcas M, Marce S, Villamor N et al. Equilibrative nucleoside transporter-2 (hENT2) protein expression correlates with ex vivo sensitivity to fludarabine in chronic lymphocytic leukemia (CLL) cells. Leukemia 2005; 19: 64 – 8.
- 23.
Mackey JR, Galmarini CM, Graham KA et al. Quantitative analysis of nucleoside transporter and metabolism gene expression in chronic lymphocytic leukemia (CLL): identification of fludarabine-sensitive and -insensitive populations. Blood 2005; 105: 767 – 74.
- 24.
Galmarini CM, Thomas X, Graham K et al. Deoxycytidine kinase and cN-II nucleotidase expression in blast cells predict survival in acute myeloid leukaemia patients treated with cytarabine. Br J Haematol 2003; 122: 53 – 60.
- 25.
Kakihara T, Fukuda T, Tanaka A et al. Expression of deoxycytidine kinase (dCK) gene in leukemic cells in childhood: decreased expression of dCK gene in relapsed leukemia. Leuk Lymphoma 1998; 31: 405 – 9.
- 26.
Schroder JK, Kirch C, Seeber S et al. Structural and functional analysis of the cytidine deaminase gene in patients with acute myeloid leukaemia. Br J Haematol 1998; 103: 1096 – 103.
- 27.
Galmarini CM, Graham K, Thomas X et al. Expression of high Km 5"-nucleotidase in leukemic blasts is an independent prognostic factor in adults with acute myeloid leukemia. Blood 2001; 98: 1922 – 6.
- 28.
Galmarini CM, Cros E, Graham K et al. 5 -(3 )-nucleotidase mRNA levels in blast cells are a prognostic factor in acute myeloid leukemia patients treated with cytarabine. Haematologica 2004; 89: 617 – 9.
- 29.
Rosell R, Danenberg KD, Alberola V et al. Ribonucleotide reductase messenger RNA expression and survival in gemcitabine/cisplatin-treated advanced non-small cell lung cancer patients. Clin Cancer Res 2004; 10: 1318 – 25.
- 30.
Galmarini CM, Clarke ML, Santos CL et al. Sensitization of ara-C-resistant lymphoma cells by a pronucleotide analogue. Int J Cancer 2003; 107: 149 – 54.